Načelo delovanja baterije
Kako deluje stenska ura, daljinski upravljalnik za televizor ali radijsko vodena otroška igrača? Večina ljudi bo brez oklevanja odgovorila "iz baterij" in načeloma bodo imeli prav. Vendar je malo verjetno, da bo kdo od njih lahko povedal, kako natančno je prenosna baterija potrojena, kako deluje in brez česa bi bil celoten proces prenosa električnega toka od baterije do končnega potrošnika nemogoč. Zapolnimo to nadležno vrzel v znanju.
Načelo delovanja baterije
Da bi razumeli načelo delovanja običajne baterije AA, morate imeti splošno razumevanje njene strukture. Vsaka baterija je torej sestavljena iz treh glavnih elementov - anode, katode in elektrolita. Poleg tega ima slednji lahko skoraj poljubno agregatno stanje: katoda in anoda, ki sta v fiziološki raztopini, sta načeloma tudi »baterija«, le v obliki, ki je za povprečnega človeka nenavadna.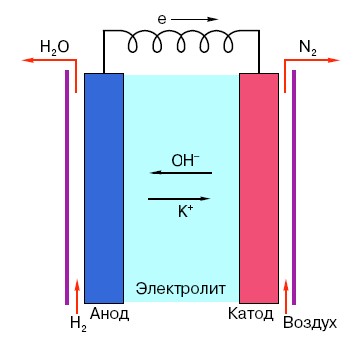
zanimivo! Tudi tako imenovani "voltaični steber", ki ga je izumil Alessandro Volta, je imel vse potrebne elemente za proizvodnjo električnega toka. Sestavljale so ga ena na drugo zložene cinkove in bakrene plošče, med katere je bila kot »plast« položena krpa, namočena v kislino.
Anoda v takih sistemih je glavni vir elektronov, ki imajo, kot vemo iz šolskega tečaja fizike, negativen naboj.Negativno nabite delce privlačijo pozitivni in v tem primeru površina katode deluje kot »plus«.
Toda to ni dovolj za nastanek električnega toka, saj elektroni potrebujejo tudi nekakšno "avtocesto" - medij, ki bi podpiral interakcijo katode in anode. Tu se "na odru" pojavi elektrolit - sol, alkalija ali kislina, ki lahko prevaja tok.
Oglejmo si načelo delovanja na posebnem primeru: obstaja baterija z nazivno napetostjo 18 voltov. Napetost med elektrodama v njem je stabilna, dokler ni priključen na omrežje. Takoj, ko se pojavi porabnik (na primer navadna žarnica), začne napetost postopoma padati, tok začne teči iz »negativne« elektrode v »pozitivno« in v elektrolitu pride do kemične reakcije, katere cilj je ohranjanje potencialne razlike med elektrodama.
Referenca. Več energije kot potrebuje porabnik, bolj intenzivna je reakcija v bateriji in hitreje bo odpovedala.
Kako deluje polnilna baterija, kako se razlikuje od navadne
Torej, pogledali smo klasične “prstne” in “mezince” baterije in vemo, da je življenjska doba večine strogo omejena (ne glede na to, kaj pravijo znani proizvajalci). Kaj pa tako imenovane baterije - baterije tipa baterij, ki ne morejo le porabiti energije med reakcijskim procesom, ampak jo tudi akumulirajo in shranijo za dolgo časa?
Da bi razumeli načelo delovanja baterije, se je treba obrniti na kemijo. Vzemimo za primer ... Običajni ogenj na oglje.Ne glede na to, kako lep in fascinanten je plamen videti, vsak kemik, ki ga opazuje, ve, da je ta proces le dolgotrajna reakcija oksidacije goriva. Goreči premog medsebojno deluje s kisikom in kot rezultat te reakcije dobimo:
- ogljikov dioksid;
- svetloba;
- toplo.
In če sta zadnji dve točki sposobni ogreti dušo in telo, potem ogljikovega dioksida nikakor ne moremo uporabiti, ker je stranski produkt reakcije, ki je pravzaprav njen odpadek. Reakcija oksidacije se ustavi, ko zmanjka izhodnih elementov: kisika in premoga. Zaustavitev reakcije v bateriji se zgodi na popolnoma enak način, ko so izhodiščne snovi popolnoma izčrpane in ostanejo samo »odpadki«.
V bateriji se vse zgodi nekoliko drugače. Dejstvo je, da reakcija, ki se pojavi v njem, spada v kategorijo reverzibilnih, to je, da se pod določenimi pogoji lahko "obrne" in vrne vse snovi v prvotno stanje. Možnost reverzibilne reakcije, ki se pojavi v bateriji, omogoča njeno polnjenje.
V bateriji, ki je priključena na omrežje, reakcija poteka v nasprotni smeri in tok teče od "plus" do "minus" in ne obratno. Posledično reakcijski produkt tvori izhodne snovi, lastnik baterije pa prejme razpoložljivo "regenerirano" energijo v prenosni obliki. To je vse!





